|
快速测定食用油中3种邻苯二甲酸酯含量的方法
邻苯二甲酸酯类物质(简称PAEs),俗名塑化剂,是常用的增塑剂,主要用于塑料制品中增加其韧性、塑性,被广泛应用在食品包装材料中[1-3]。但是在塑料制品中,PAEs与塑料分子结合力较弱,随着塑料制品的老化,PAEs很容易从其中释放出来,迁移到与之接触的食品中[4-7]。尤其PAEs是脂溶性物质,因此极易迁移到食用油中,造成油脂污染[8-9]。
研究表明,PAEs的急性毒性并不明显,但是长期摄入累积,可引起肝、肾、肺及心脏、生殖等多组织系统的中毒,其中以雄性生殖系统损害最为明显[10-16]。因此原卫生部《关于通报食品及食品添加剂邻苯二甲酸酯类物质最大残留量的函》(卫办监督函〔2011〕551号)明确规定了食用植物油中的邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二(2-乙基)己酯(DEHP)和邻苯二甲酸二异壬酯(DINP)最大残留量分别不得超过0.3、1.5、9.0mg/kg。
由于GC-MS具有对目标物定性定量准确、对痕量物质分析灵敏度高等优点,可应用在食品中邻苯二甲酸酯类含量的测定。本试验主要对食用植物油的前处理条件进行优化,使得前处理具有快速、准确的优势,利用GC-MS测定DBP、DEHP和DINP的含量,以期为企业大批量的测定食用植物油中PAEs提供方法参考。
1材料与方法
1.1试验材料
1.1.1原料与试剂
16种PAEs混标(10mg/L,1mL,上海安谱):邻苯二甲酸二甲酯(DMP),邻苯二甲酸二乙酯(DEP),邻苯二甲酸二异丁酯(DIBP),邻苯二甲酸二丁酯(DBP),邻苯二甲酸二(4-甲基-2-戊基)酯(BMPP),邻苯二甲酸二甲氧乙酯(DMEP),邻苯二甲酸二戊酯(DPP),邻苯二甲酸二乙氧基乙基酯(DEEP),邻苯二甲酸二己酯(DHXP),邻苯二甲酸丁苄酯(BBP),邻苯二甲酸二丁氧基乙酯(DBMP),邻苯二甲酸二(2-乙基)己酯(DEHP),邻苯二甲酸二环己酯(DCHP),邻苯二甲酸二苯酯(DPHP),邻苯二甲酸二正辛酯(DNOP),邻苯二甲酸二壬酯(DNP)。邻苯二甲酸二异壬酯(DINP)标准品(1000mg/L,2mL),上海安谱;乙腈,正己烷,丙酮;二氯甲烷,色谱纯;SBEQ-CA8645玻璃纯油基质萃取管,上海安谱;1g/6mLPSA/SPE小柱,迪马公司;一次性玻璃滴定管;1mL玻璃样品瓶;油脂样品均购于沃尔玛超市。
1.1.2仪器与设备
7890B-5977B气相色谱-质谱联用仪,安捷伦公司;EOFO-945066型Talboys数显型多管式旋涡混合器,美国Talboys;TD5A-WS台式低速离心机。
1.2试验方法
1.2.1标准溶液的配制
16种PAEs标准工作液:用正己烷配制0.00、0.02、0.05、0.10、0.20、0.50、1.00μg/mL的16种PAEs标准系列溶液。于-20℃保存。
DINP标准工作液:用正己烷配制0.0、0.5、10、2.5、5.0、10.0、20.0μg/mL的DINP标准系列溶液。于-20℃保存。
1.2.2样品前处理
1.2.2.1本试验方法
用一次性玻璃滴定管取0.5g(精确至0.0001g)植物油于10mL纯油基质萃取管中,加入2mL乙腈,放入旋涡混合器中于2500r/min下混匀萃取5min,然后4000r/min离心2min,取出后将上清液移入1mL样品瓶中,待GC-MS测定。
1.2.2.2GB5009.271—2016方法
食用植物油混匀后,准确称取0.5g(精确至00001g)于10mL具塞磨口离心管中,依次加入100μL正己烷和2mL乙腈,涡旋1min,超声提取20min,4000r/min离心5min,收集上清液。残渣中加入2mL乙腈,涡旋1min,4000r/min离心5min。再加入2mL乙腈重复提取1次,合并3次上清液,待SPE净化。
取PSA/SPE小柱,依次加入5mL二氯甲烷、5mL乙腈活化,弃去流出液;将待净化液加入PSA/SPE小柱,收集流出液;再加入5mL乙腈,收集流出液,合并两次收集的流出液,加入1mL丙酮,40℃氮吹至近干,正己烷准确定容至2mL,涡旋混匀,供GC-MS分析。
1.2.3仪器条件
GC条件:HP-5-MS色谱柱(30m×0.25mm×025μm);进样口温度260℃;程序升温为初始柱温60℃,保持1min,以20℃/min升温至220℃,保持1min,再以5℃/min升温至250℃,保持1min,再以20℃/min升温至290℃,保持7.5min;载气为高纯氦气(纯度>99.999%),流速1.0mL/min;进样方式为不分流进样;进样量1μL。
MS条件:电离方式为电子轰击电离源(EI);电离能量70eV;传输线温度280℃;离子源温度230℃;四级杆温度150℃;监测方式为选择离子扫描(SIM);溶剂延迟7min。
1.2.4定性确认
在1.2.3仪器条件下,待测样品和PAEs标准品的目标化合物在相同保留时间处(±0.5%)出现,并且对应质谱碎片离子的质荷比与标准品的质谱图一致,其丰度比与标准品相比应符合表1,3种PAEs的定性和定量离子见表2。结合丰度比和定性离子可定性目标化合物。

2结果与分析
2.1标准曲线和检出限
将标准系列工作液分别注入GC-MS中,每个质量浓度平行测定3次,测定相应的PAEs色谱峰面积,以标准工作液的质量浓度(X)为横坐标,以相应的峰面积(Y)为纵坐标,绘制标准曲线。DINP的标准系列工作液单独进样测定。取某一低质量浓度的标准溶液,用空白植物油逐级稀释,按照1.2.2.1方法处理后,以3倍信噪比所对应的质量浓度为检出限(LOD),以10倍检出限作为定量限(LOQ),结果见表3。
由表3可知,DBP和DEHP的线性范围在0~1.0μg/mL之间,相关系数大于0.999,DINP的线性范围在0~20μg/mL之间,相关系数为0.9994,表明DBP、DEHP和DINP的线性均良好。DBP、DEHP和DINP的LOD和LOQ均分别为0.05μg/mL和05μg/mL。
2.2本方法的影响因素
2.2.1空白试验
实验中尽量避免使用塑料制品,对于玻璃器皿,用超纯水洗净,烘干后,使用前用色谱纯正己烷清洗3~4遍,甩干,待正己烷挥发后使用。每次试验用的试剂都进GC-MS测定其PAEs含量,待测定值在检出限以下,方可使用。
2.2.2净化管的选择
采用安谱的纯油基质萃取管作为净化管,该基质主要是活化的氧化铝,吸附油脂性能较好,价格较低,8元/根。而国标采用的PSA/SPE固相萃取柱(1g/6mL)虽然净化效果好,但价格昂贵,需40元/根。考虑到企业检测样品数量众多,在除油效果良好、对GC-MS无污染、价格低廉的情况下,采用安谱的纯油基质萃取管作为净化管。
2.2.3乙腈萃取量的影响
称取空白一级菜籽油0.5g,加入适量标准溶液,使其分别含0.5μg/mL的DBP、DEHP和DINP溶液,分别加入2、4、6mL乙腈,在2500r/min下混匀萃取5min,离心2min,而后测定该样品中DBP、DEHP、DINP的含量。试验结果表明:分别加入2、4、6mL乙腈萃取时,样品中DBP、DEHP和DINP的加标回收率为95%以上。故试验选择2mL作为乙腈萃取量。
2.2.4萃取时间的影响
本试验方法中,称取空白一级菜籽油0.5g,加入适量标准溶液,使其分别含0.5μg/mL的DBP、DEHP和DINP溶液,加入2mL乙腈,分别在旋涡混合器中2500r/min下混匀萃取5、10、15、20min,离心2min,而后测定该样品中DBP、DEHP、DINP的含量。试验结果表明:当萃取时间分别为5、10、15、20min时,样品中DBP、DEHP和DINP的加标回收率均能达到95%以上。故试验选择5min作为萃取时间。
2.2.5萃取方式的影响
本试验方法中,称取空白一级菜籽油0.5g,加入适量标准溶液,使其分别含0.5μg/mL的DBP、DEHP和DINP溶液,加入2mL乙腈,分别在旋涡混合器中于2500r/min下萃取5min和超声20min,离心2min,而后测定该样品中DBP、DEHP、DINP的含量。试验结果表明:采用旋涡混合器萃取的效果与超声萃取效果相当,旋涡混匀萃取和超声萃取的样品中DBP、DEHP和DINP加标回收率均在95%以上。本试验选择旋涡混匀作为萃取方式。
2.3仪器稳定性
将低(0.02μg/mL)、中(0.5μg/mL)、高(1.0μg/mL)3种质量浓度的标准溶液进入GC-MS中进行测定,重复测定6次,计算3种质量浓度的相对标准偏差(RSD)分别为5.6%、4.5%和4.1%,均在10%以下,说明仪器稳定性良好。
2.4方法准确性
将未测出DBP、DEHP和DINP的一级菜籽油作为本底,向其中加入标准溶液,配制成低(0.02μg/mL)、中(0.5μg/mL)、高(1.0μg/mL)3种质量浓度的加标样。分别采用本试验方法和GB5009.271—2016进行前处理。每个水平平行测定6次,计算平均回收率和RSD。结果见表4。
从表4可看出,在本试验方法中,当加标量分别为0.02、0.5μg/mL时,DBP、DEHP和DINP的加标回收率分别为103%~112%、96%~113%、95%~97%,RSD分别为5.5%~5.9%、5.0%~6.6%和3.5%~5.5%。当加标量为1.0μg/mL时,DBP、DEHP和DINP的加标回收率分别为73%、64%和62%,RSD分别为5.6%、4.6%和3.3%。
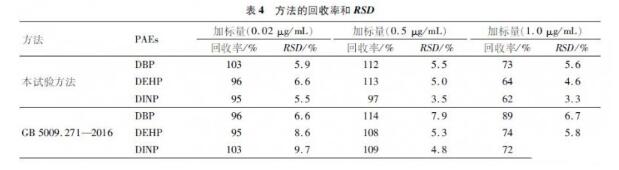
在GB5009.271—2016方法中,当加标量分别为0.02、0.5μg/mL时,DBP、DEHP和DINP的加标回收率分别为96%~114%、95%~108%、103%~109%,RSD分别为6.6%~7.9%、5.3%~86%和4.8%~9.7%。当加标量为1.0μg/mL时,DBP、DEHP和DINP的加标回收率分别为89%、74%和72%,RSD分别为6.7%、5.8%和7.2%。
由此可见,当加标量在0.5μg/mL时,两种方法的加标回收率均在95%以上。但当加标量在1.0μg/mL时,国标方法的回收率较高,原因是萃取的次数较多,萃取较完全。但是国标方法萃取次数多,耗时长,容易二次污染,且0.5μg/mL的加标回收率达95%以上时完全能满足日常食用植物油中的DBP、DEHP和DINP的测定。
2.5样品比对结果
将5个不同的油样送到通标标准技术服务有限公司(简称SGS)进行DBP、DEHP和DINP含量的测定,并分别采用本试验方法和GB5009.271—2016进行测定,将三者的结果进行比对。结果见表5。
由表5可知,本试验方法测定结果与GB5009.271—2016和SGS的测定结果基本一致,说明本试验方法测定的结果准确、可靠。
2.6实际样品的测定
随机抽取9份不同油样应用本方法测定DBP、DEHP、DINP含量,结果见表6。
由表6可知,随机抽取的9份油样测定的DBP、DEHP和DINP含量均在国家标准限量之下,这对于消费者的食用是安全的。
3结论
本试验建立了一种用于食用植物油中DBP、DEHP和DINP含量的快速测定方法。采用加标回收率作为判断标准,分别对油脂净化管的选择、萃取量、萃取方式和萃取时间进行了试验,建立了一种快速、简便、准确的检测方法。利用该方法,DBP和DEHP在0~1.0μg/mL质量浓度范围内,相关系数均大于0.999;DINP在0~20μg/mL质量浓度范围内,相关系数为0.9994;且DBP、DEHP和DINP的检出限和定量限均分别为0.05、0.5μg/mL。0.5μg/mL的加标样品中的DBP、DEHP和DINP回收率均在95%以上,RSD在10%以下。采用本试验方法测定的结果与GB5009.271—2016和SGS测定结果基本一致。
参考文献:
[1] 叶常明,田康. 邻苯二甲酸酯类化合物生物降解动力学[J]. 环境科学学报,1989,9(1):27.
[2] 张景,王竹天,樊永祥,等. 邻苯二甲酸酯类的毒性、分析方法及使用规定[J]. 中国食品卫生杂志,2012,24(5):504-517.
[3] 桂祖桐. 邻苯二甲酸酯增塑剂对健康和环境影响的评估及其对消费量的影响[J]. 塑料助剂,2006(3):39-42.
[4] 王瑞元,金青哲,安骏. 塑化剂与粮油制品的安全[J]. 中国油脂,2013,38(4):1-4.
[5] 崔虹,王雪平. 浅谈食品中塑化剂的来源、危害与测定方法[J]. 华章,2011(25):323.
[6] 李明元,胡银川. 食品塑料包装中PAEs迁移危害研究现状[J]. 食品与生物技术学报,2010,29(1):14-16.
[7] 杨悠悠,谢云峰,田菲菲,等. 常见食品中邻苯二甲酸酯类增塑剂含量及食品包装材料中邻苯二甲酸酯类增塑剂迁移量的测定[J]. 色谱,2013,31(7):674-678.
[8] NANNI N,FTSELIER K,GROB K,et al. Contamination of vegetable oils marketed in Italy by phthalic acid esters[J]. Food Control,2011,22(2):209-214.
[9] 徐颖,郭立新,蔡曹盛. 食用油中增塑剂溶出的原因分析及风险预测[J]. 中国油脂,2012,37(5):48-50.
[10] 刘慧杰, 舒为群. 邻苯二甲酸酯类化合物的毒理学效应及对人群健康的危害[J]. 第三军医大学学报, 2004,26(19):1778-1781.
[11] 靳秋梅,孙增荣. 邻苯二甲酸酯类化合物的生殖发育毒性[J]. 天津医科大学学报,2004,10(S1):15-18.
[12] LIN S,KU H Y,SU P H,et al. Phthalate exposure in pregnant women and their children in central Taiwan[J]. Chemsphere,2011,82:947-955.
[13] 王民生. 邻苯二甲酸酯(塑化剂)的毒性及对人体健康的危害[J]. 江苏预防医学,2011,22(7):68-70.
[14] 王玉邦,王心如. 邻苯二甲酸酯类生殖内分泌毒性[J]. 环境与职业医学,2002,20(6): 457-460.
[15] 柳春红,孙远明,杨艺超,等. 邻苯二甲酸酯类增塑剂的污染及暴露评估现状[J]. 现代食品科技,2012,28(3):339-312.
[16] 吴德生,秦逍云,谭琴,等. 邻苯二甲酸酯类化合物的生殖毒性及其环境内分泌干扰效应[J]. 癌变·畸变·突变,2015,27(4):316-318.

|


